Vedení elektrického proudu v kapalinách - elektrolýza
Většina kapalin v čistém stavu jsou izolanty.
Vezměme
nádobu, upevněme do ní dvě kovové desky a ty připojme přes ampérmetr ke zdroji
napětí. Do nádoby nalijme destilovanou vodu. Elektrický proud obvodem
neprochází. Osolíme-li vodu, začne proud obvodem procházet. Na pokus se můžete
podívat na video
¤ (soubor *.rm, 501 kB; ev.
soubor *,avi ¤
2786 kB).
Destilovaná voda nevede elektrický proud, protože v ní nejsou přítomny žádné volné částice s nábojem. Pokud do ní nasypeme sůl (chemicky NaCl), proběhne elektrolytická disociace - NaCl se rozloží na ionty Na+ a Cl-. To už jsou volné částice s nábojem, proto po přiložení napětí obvodem elektrický proud prochází.
Obecně nazýváme disociací vznik iontů při rozpouštění kyselin, solí a
zásad ve vodě.
Např.:
H2SO4 ® 2H+ + SO42– (disociace
kyseliny)
KOH ® K+ + OH– (disociace zásady)
NaCl ® Na+ + Cl– (disociace
soli)
Něco k názvosloví: Kapalina, která vede elektrický proud, se nazývá elektrolyt, vodivé desky, které jsou do ní ponořené a ke kterým je připojen zdroj napětí, jsou elektrody. Kladná elektroda je anoda, záporná katoda. Kladné ionty se nazývají kationty (jsou totiž přitahovány ke katodě), záporné ionty pak anionty (viz obr. 1).
To, jestli bude elektrolýza probíhat, závisí na napětí zdroje. Napětí
musí disociovat látky, až potom může obvodem procházet proud. Pro proud, který
prochází elektrolytem platí:
![]()
Ur je rozkladné napětí.
Čím větší je vzdálenost elektrod, tím větší je odpor Þ klesá proud. Čím víc jsou elektrody ponořené
do elektrolytu, tím větší je proud (větší účinná plocha).

obr. 1: Názvosloví
Jiný příklad vedení elektrického proudu v kapalinách
(elektrolytech) je tento:
elektrolyt modrá skalice (CuSO4)
anoda: měď
katoda: uhlík
Probíhají tyto reakce:
Elektrolytická disociace: CuSO4 ---> Cu2+ + SO42-
Na katodě: Cu2+ + 2e- ---> Cu (měď z roztoku získá od katody dva elektrony a vylučuje
se na ní)
Na anodě: SO42- ---> SO4 + 2e-
SO4 + Cu ---> CuSO4 (SO4
odevzdá anodě dva elektrony a "vezme si" z ní jeden atom mědi - anoda
se rozpouští)
Koncentrace elektrolytu se nemění (jedna molekula CuSO4 je na
začátku reakce a rovněž jedna molekula CuSO4 je na konci).
Toto je základ průmyslové metody zvané galvanické
pokovování - nanášení tenkých vrstev jiného kovu na nějaký vodivý povrch
(např. chromované kliky, nárazníky, ...). Předmět, který chceme pokovit, se
použije jako katoda, kov, kterým budeme pokovovat, jako anoda a elektrolyt bude
sůl tohoto kovu (v našem případě jsme pokovovali mědí, tedy elektrolyt byl CuSO4).
Změříme-li voltampérovou charakteristiku, zjistíme, že platí Ohmův zákon U = RI (U je napětí na
elektrolytu, I proud jím procházející a R je odpor
elektrolytu). Odpor elektrolytu se chová stejně jako odpor kovů ¤ - když k sobě elektrody přiblížíme,
odpor klesá (zmenšuje se "délka vodiče"), když nalijeme více
elektrolytu, odpor rovněž klesá (zvětšuje se "průřez vodiče"). Na
pokus se podívejte na video
¤ (soubor *.rm, 441 kB; ev.
soubor *,avi ¤
2553 kB).
Výroba elektrického napětí
Udělejme další pokus. Jako elektrolyt použijeme zředěnou kyselinu sírovou (H2SO4),
jedna elektroda bude zinková a druhá měděná. K elektrodám připojíme voltmetr
(obr. 2). Na pokus se podívejte na video
¤ (soubor *.rm, 240 kB; ev.
soubor *,avi ¤
1527 kB).

obr. 2: Měděná a zinková elektroda v roztoku H2SO4
Voltmetr ukazuje napětí mezi elektrodami 1 V, přičemž zinková elektroda
je záporná a měděná kladná. Jak toto napětí vzniká?
Měděná elektroda se v kyselině rozpouští. To znamená, že kladné ionty (jádro +
valenční elektrony) mědi přecházejí do elektrolytu (vodivostní
elektrony v kovech tvoří elektronový plyn a zůstávají v elektrodě). Elektroda
se tak nabíjí záporně a elektrolyt kladně.
Zinková elektroda se rovněž v kyselině rozpouští a nabíjí se tak záporně.
Zinková elektroda se však rozpouští mnohem více, a proto je
"zápornější" než měděná elektroda. Měděná elektroda má tedy vyšší
potenciál než zinková a mezi oběma elektrodami je tudíž elektrické napětí.
Spojíme-li je vodičem, protéká jím elektrický proud (obr. 3).
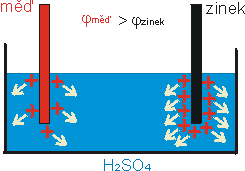
obr. 3: Rozpouštění měděné a zinkové elektrody v kyselině sírové. Rozpouštěním
přechází do kyseliny kladné ionty a elektrody se nabíjí záporně. Zinková
elektroda se rozpouští více a její potenciál je tedy menší než potenciál měděné
elektrody.
Tato dvojice elektrod je tedy zdrojem elektromotorického napětí. Obecně
vzniká napětí mezi dvojicí elektrod z různého materiálu, které jsou
ponořeny do elektrolytu. Podobně fungují i monočlánky
(tužkové baterie). V nich je jako katoda použita zinková nádobka, jako anoda
uhlíková tyč. Ta je obklopena směsí burelu a uhlíku, která slouží jako depolarizátor. Průchodem proudu elektrolytem totiž probíhá
elektrolýza a na elektrodách se usazují sloučeniny, které snižují napětí mezi
nimi. Článek se tak vybíjí. Depolarizátor zpomaluje
usazování sloučenin a prodlužuje tak životnost článku.
Jako elektrolyt je v článku salmiak (NH4Cl), který je zahuštěn škrobem
a má tak kašovitou konzistenci (obr. 4).

obr. 4: Monočlánek skládající se z uhlíkové tyčinky (anoda), zinkové nádoby
(katoda), salmiaku (elektrolyt) a burelu s uhlíkem (depolarizátor).
Salmiak je shora zalit krycí hmotou (není zakreslena) a uhlík je opatřen
kovovou čepičkou.
Tento článek dává napětí 1,5 V. Potřebujeme-li větší napětí, použijeme plochou baterii dávající napětí 4,5 V. Tato
baterie obsahuje tři monočlánky spojené do série (obr. 5).

obr. 5: Plochá baterie - sériové spojení tří monočlánků
Monočlánek nelze po vybití znovu nabít. Zdroj stejnosměrného napětí, který
lze nabíjet, se nazývá akumulátor.
Například olověný akumulátor vytvoříme vložením dvou olověných elektrod do
elektrolytu - zředěné kyseliny sírové. Na elektrodách vznikne vrstvička PbSO4.
Povrch obou elektrod je ze stejného materiálu, akumulátor je vybit (obr. 6).
Elektrolyt je disociován na H+ a SO42-.
Připojíme-li elektrody ke zdroji vnějšího napětí, probíhají následující
chemické reakce:
Na katodě: 2H+ + 2e- ---> 2H
2H + PbSO4 ---> Pb + H2SO4
Na anodě: SO42- ---> SO4 + 2e-
SO4 + PbSO4 + 2H2O ---> 2H2SO4
+ PbO2
Hustota elektrolytu se zvyšuje (na jednu molekulu H2SO4
na začátku reakce jsou tři molekuly H2SO4 na konci). Na
katodě se spotřebovává vrstvička PbSO4 a zůstává tak čisté olovo, na
anodě se PbSO4 mění na PbO2. Jakmile se spotřebuje celá
vrstvička PbSO4 na katodě, začne se na ní vylučovat plynný vodík (už
nemá s čím reagovat). to je znamení, že akumulátor je nabit (obr. 7). Napětí
mezi elektrodami je 2,1 V. Když je nyní spojíme přes zátěž, bude obvodem
protékat proud.
|
|
|
|
obr. 6: Vybitý olověný akumulátor. Obě elektrody jsou
obaleny PbSO4. |
obr. 7: Nabitý olověný akumulátor. katoda je čisté olovo,
anoda je pokryta PbO2. |
Průchodem proudu se akumulátor vybíjí (probíhají opačné chemické reakce než
při nabíjení a elektrody se opět pokrývají vrstvičkou PbSO4). Po
vybití ho můžeme zase znovu nabít.
Faradayovy zákony elektrolýzy
Na rozdíl od vedení proudu v kovech ¤, kde přenos náboje
obstarávají prakticky nehmotné elektrony ¤, je při vedení proudu v
kapalinách náboj přenášen hmotnými ionty. Přenos náboje je tedy doprovázen
přenosem hmoty.
Při elektrolýze se na katodě
vždy vylučuje kov nebo vodík.
Procesy na anodě mohou být složitější – mohou se na ní též vylučovat různé
látky, může ale docházet také k rozpouštění anody. Každá vyloučená molekula
přijme z katody a odevzdá anodě několik elektronů. K vyloučení jedné molekuly
na katodě musí tedy ionty přijmout n elementárních nábojů e – jedna molekula se vyloučí nábojem
Q = n × e
Pro Na+ nebo Cl– je n = 1; pro Cu2+ nebo O2–
je n = 2 → Pro každý iont platí Xn+ nebo Xn–
Projde-li povrchem elektrody celkový náboj Q = I × t, je počet vyloučených molekul
![]()
Vynásobíme-li toto číslo hmotností jedné molekuly
![]()
(Mm – molární hmotnost vyloučené látky, NA – Avogadrova
konstanta = 6,022 × 1023)
dostaneme celkovou hmotnost vyloučené látky:
![]()
F = NA × e – Faradayova konstanta
(udává náboj, kterým se vyloučí 1 mol jednomocného prvku): F = 9,65.104
C × mol–1
Odvozený vztah vyjadřuje zákony, které Faraday
objevil v roce 1833:
1. Faradayův
zákon:
Hmotnost m vyloučené látky je přímo úměrná náboji Q, který prošel elektrolytem:
m = A × Q = A × I × t
A – elektrochemický
ekvivalent, jednotka kg × C–1
Udává množství látky vyloučené proudem 1 A za 1 s Þ definice ampéru:
Proud 1 A vyloučí za 1 s 1,118
g stříbra.
2. Faradayův zákon (podleM. Faradaye ¤
):Elektrolýzy
se využívá v metalurgii, při galvanickém pokovování, v galvanoplastice atd.
Další
použití elektrolýzy
Elektrolýza
je rovněž základem polarografie, za kterou dostal v roce 1959
Nobelovu cenu český chemik Jaroslav Heyrovský ¤. Polarografie umožňuje měřit výskyt a
koncentraci nepatrného množství různých látek v roztocích - viz zde ¤.

