Kapaliny mají stálý objem, ale už ne tvar.
Kapaliny tvoří přechod
mezi úplně uspořádanými pevnými látkami a neuspořádanými plyny. Uspořádání
kapalin je krátkodosahové, podobné
amorfním látkám. Molekuly kapalin se po krátký časový úsek pohybují
v kmitech kolem jedné rovnovážné polohy, ale mají takovou kinetickou
energii, že z této rovnovážné polohy uniknou a zaujmou jinou polohu.
Zahřátí kapaliny se projeví zvýšením kinetické energie molekul a tím kratším
intervalem, ve kterém setrvávají kolem jedné rovnovážné polohy. My to rozeznáme
zvýšením tekutosti (např. med za pokojové teploty teče ze lžičky velmi pomalu,
při ohřátí asi jako sirup). Molekuly kapaliny na sebe vzájemně působí
přitažlivými silami. Tyto síly mají vliv na vlastnosti kapaliny.
Volný povrch
kapaliny se
chová jako pružná blána (kapky na
okně, kapka u kohoutku → je to, jako by se nafukoval balónek). Je to
způsobeno vzájemným silovým působením molekul. Kolem každé molekuly je silové pole. V poloměru rm je velikost tohoto
silového působení ještě patrná.
Když je celé kulové silové pole dané molekuly
uvnitř kapaliny, je výslednice
přitažlivých sil, kterými ostatní molekuly v kapalině působí na danou
molekulu, nulová. 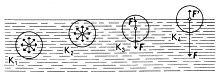
Ovšem jiná situace nastane, když je vzdálenost
molekuly od volné povrchu kapaliny menší než rm. Molekuly plynu, které působí na danou molekulu už
nevyvolají takovou přitažlivou sílu jako molekuly kapaliny, proto výslednice sil působí dovnitř kapaliny.
Vrstva molekul, které mají vzdálenost od volného
povrchu kapaliny vzdálenost menší než rm,
se nazývá povrchová vrstva kapaliny.
Na každou
molekulu ležící v povrchové vrstvě kapaliny působí sousední molekuly
výslednou přitažlivou silou, která má směr dovnitř kapaliny. Volný povrch je kolmý na směr této síly.
Při posunutí molekuly z vnitřku kapaliny do
povrchové vrstvy je nutno vykonat práci k překonání této síly. Molekuly
povrchové vrstvy mají větší energii než ostatní molekuly. Celá povrchová vrstva
má povrchovou energii. Je to
energie, kterou mají molekuly povrchové vrstvy navíc ve srovnání se stejným
počtem molekul uvnitř kapaliny. Povrchová energie je jedna ze složek vnitřní
energie kapaliny.
Kapalina má snahu mít co nejmenší energii, proto se
snaží mít i nejmenší energii povrchovou. Proto se snaží mít při daném objemu
co nejmenší povrch. Pokud bychom porovnali povrch těles o stejném objemu,
zjistili bychom, že nejmenší
povrch vzhlede k objemu má koule.
Proto se i kapalina snaží vytvořit kulovitý
tvar. Takový tvar by měla, kdyby na ni nepůsobily vůbec žádné síly. Na Zemi
ale působí tíha, proto kapaliny zaujímají kapkovitý tvar.
Když chceme zvětšit velikost povrchu kapaliny
o DS, musíme dodat přírůstek
povrchové energie DE,
kterou musíme dodat molekulám, které se staly molekulami povrchové vrstvy
kapaliny.
Veličina, která charakterizuje závislost povrchové
energie kapaliny na jejím povrchu je povrchové
napětí s
![]()
[s] = J × m–2 = N × m–1
Povrchové napětí závisí na kapalině, na látce nad volným
povrchem, na teplotě kapaliny.
Když vytvoříme blánu z mýdlového roztoku
v drátěném rámečku, jehož jedna strana je pohyblivá, posune blána
samovolně pohyblivou stranu o Dx.
Při tom na stranu působí oba povrchy (horní i dolní) povrchovou silou F. Vykoná
se práce W = 2 × F × Dx a
zároveň se plocha blány zmenší o plochu DS = 2 × l × Dx (opět se zmenší horní i dolní povrchová
vrstva), kde l je délka pohyblivé
strany
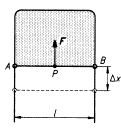
![]()
Povrchové napětí ![]() se rovná podílu
velikosti povrchové síly F a délky l okraje povrchové blány, na který povrchová
síla působí kolmo k povrchu kapaliny.
se rovná podílu
velikosti povrchové síly F a délky l okraje povrchové blány, na který povrchová
síla působí kolmo k povrchu kapaliny.
Jevy na rozhraní pevného tělesa a kapaliny

Nalijeme-li kapalinu do nádoby, u hladiny na sebe
budou vzájemně působit molekuly stěny nádoby, molekuly plynu nad hladinou a
molekuly kapaliny. Nádoba působí silou F1, kapalina silou F2
a plyn silou F3, která je vzhledem k druhým dvěma silám
zanedbatelná. Výslednice sil určuje sklon hladiny, která je kolmá na povrchovou
sílu. Mohou nastat dva případy:
Síla směřuje do nádoby – kapalina smáčí stěnu nádoby, tzn. u stěny se vytvoří meniskus, malý zdvih hladiny – např. voda. Kapalina vytváří dutý povrch.
Síla směřuje do kapaliny – kapalina nesmáčí stěnu nádoby – např. rtuť, kapalina vytváří vypuklý povrch.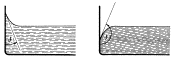
Hladina svírá se stěnou nádoby stykový úhel J. Pro 0 < J < p/2 rad kapalina smáčí, pro p/2 < J < p rad nesmáčí. Voda má J = 8°, rtuť 128°.
Je-li J = 0 rad, kapalina dokonale
smáčí stěny, pro p/2 je povrch kapaliny
nezakřivený, pro p kapalina dokonale nesmáčí.
Ponoříme-li trubici s velmi malým vnitřním
průměrem (kapiláru – r < 1
mm) svisle do kapaliny, vytvoří se v ní u kapalin smáčejících dutý
kulový vrchlík nad hladinou kapaliny
– kapilární elevace; u kapalin
nesmáčejících se vytvoří vypuklý kulový vrchlík níže než je hladina okolní kapaliny – kapilární deprese.
Při kapilární elevaci vystoupá kapalina do takové
výšky, ve které bude povrchová a
tíhová síla kapaliny v rovnováze.
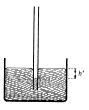


l je obvod hladiny
v kapiláře, V je objem
kapaliny v kapiláře.
Z těchto vzorců lze určit povrchové napětí
kapaliny nebo určit, jak vysoko by kapalina vystoupala.
Tlak pod
zakřiveným povrchem kapaliny způsobený pružností povrchové vrstvy se nazývá
kapilární tlak.
Pod dutým povrchem je vnitřní tlak ve srovnání
s tlakem pod vodorovným povrchem menší než kapilární tlak. Pod vypuklým
povrchem kapaliny je naopak vnitřní tlak ve srovnání s tlakem pod
vodorovným povrchem větší o kapilární tlak.
Z měření i teoretického odvození vyplývá, že má-li
povrch kapaliny tvar kulového vrchlíku (resp. koule, např. u kapky), je
kapilární tlak pk dán vztahem
![]() ,
,
kde
![]() je povrchové napětí kapaliny a R poloměr kulového povrchu.
je povrchové napětí kapaliny a R poloměr kulového povrchu.
U tenké kulové bubliny se dvěma povrchy
(např. mýdlové bubliny) o poloměru R je
![]()
Kapilární jevy mají velký praktický význam. Na
kapilární elevaci je založena výživa rostlin – voda s živinami
vzlíná kmenem. Kapilární elevací vzlíná petrolej knotem, ale také vlhnou
stěny podmáčených domů.